DIE FIREBUSTERS
NATRIUM & WASSER
Natrium (Na) ist eines der häufigsten Elemente auf der Erde. Weil es zu den sehr unedlen Metallen gehört, die ausgesprochen reaktionsfreudig sind, kommt es jedoch nicht elementar vor, sondern immer in gebundener Form. Die wichtigste chemische Verbindung ist dabei das Kochsalz (NaCl), welches auch oft als „Weißes Gold“ bezeichnet wird. Natrium ist das meistgebrauchte Alkalimetall und wird in reiner Form als Kühlmittel (z. B. in Brutreaktoren) und in der Wissenschaft in Labors verwendet. Sein natürlicher Feind ist dabei das Wasser, mit welchem es intensiv reagiert.
W
irft man ein kleines Stück Natrium (Na) in eine Glasschale, welche teilweise mit Wasser (H2O) gefüllt ist, zeigt sich eine heftige Reaktion des Natriumteilchens mit dem Wasser. Dabei entsteht Natronlauge (NaOH) und Wasserstoff (H2). Dieser gerät dann meist auch in Brand, ja er kann sogar in Form einer kleinen Explosion umgesetzt werden.
Wirft man ein kleines Stück Natrium (Na) in eine Glasschale, welche teilweise mit Wasser (H2O) gefüllt ist, zeigt sich eine heftige Reaktion des Natriumteilchens mit dem Wasser. Dabei entsteht Natronlauge (NaOH) und Wasserstoff (H2). Dieser gerät dann meist auch in Brand, ja er kann sogar in Form einer kleinen Explosion umgesetzt werden. Wegen seiner Reaktionsfreudigkeit muss Natrium daher unter einer Schutzflüssigkeit (Paraffinöl oder Benzin) aufbewahrt werden.
Wegen seiner Reaktionsfreudigkeit muss Natrium daher unter einer Schutzflüssigkeit (Paraffinöl oder Benzin) aufbewahrt werden.
Laborbrand
Einen der folgenschwersten Natrium-Brände gab es am 7. März 2006 am Biochemie-Institut der Universität Graz. Bei Vorbereitungsarbeiten, die zwei Laborantinnen durchführten, zerbrach ein Gefäß mit etwa 500 Gramm Natrium, welches in den Abfluss fiel. Dort kam es zu einer heftigen, explosionsartigen Reaktion. Die beiden Frauen konnten keine Erste Löschhilfe mehr leisten und flüchteten gerade noch im letzten Augenblick. Das gesamte Labor brannte aus, wobei auch die abgehängte Decke einstürzte.

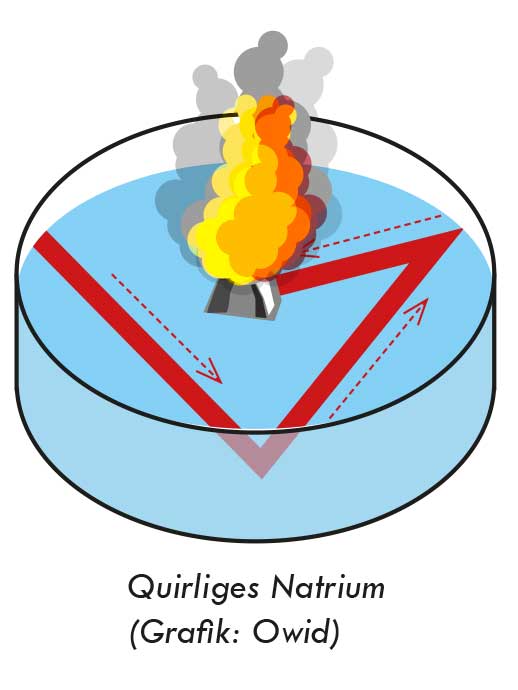
Reaktionen der Alkalimetalle mit Wasser
Im Periodensystem besitzen die Elemente einer Gruppe (sie stehen untereinander) ähnliche Eigenschaften. Dies lässt sich am Beispiel der Alkalimetalle (1. Gruppe) sehr eindrucksvoll zeigen, denn die Elemente Lithium, Natrium und Kalium zeigen alle eine stark exotherme Reaktion mit Wasser. Im folgenden Experiment wird dies anhand von Natrium demonstriert.
Materialien
- Glasschale (nieder, 10 cm Durchmesser)
- Messer, Pinzette
- Filterpapier
- Natrium (Na)
- Phenolphthalein-Indikatorlösung (C20H14O4)
- Wasser (H2O)
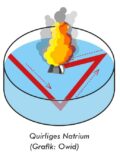
Versuch 1: Quirliges Natrium
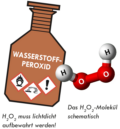
Wir schneiden ein kleines Stück Natrium (einige mm im Durchmesser) mit dem Messer ab und entrinden es, falls eine Rinde vorhanden ist. Anmerkung: Natrium oxidiert im Laufe der Zeit oberflächlich, wobei auch das sehr reaktionsfähige und explosive Natriumperoxid (Na2O2) gebildet werden kann.
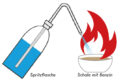
In eine halb mit Wasser gefüllte Glasschale (vorher ev. einige Tropfen Phenolphthalein dazugeben) wird nun das vorher getrocknete Natrium mit der Pinzette gelegt. Das Natriumstück beginnt zu zischen und formt sich zu einer glänzenden Kugel, die auf der Wasseroberfläche quirlig herumflitzt. Wenn man Phenolphthalein als Indikator verwendet, hinterlässt das Kügelchen eine rosarote Spur. Manchmal explodiert das Natrium sogar, was vor allem am Ende der Reaktion vorkommen kann.
Anmerkung:
Das Wasser kann vor dem Versuch mit etwas Spülmittel versehen werden. Damit wird die Oberflächenspannung herabgesetzt, und das Natriumkügelchen bleibt nicht am Rand des Gefäßes hängen.
Erklärung:
Das Natrium (Na) reagiert gemäß folgender Gleichung mit Wasser (H2O) und erzeugt Natronlauge (NaOH):
2 Na+2 H2O 2 NaOH+H2
Durch den freigesetzten Wasserstoff (H2) erfolgt ein Rückstoß, der das Natriumteilchen herumflitzen lässt. Längs seiner Bahn wird Natronlauge produziert, welche durch den Phenolphthalein-Indikator rosarot gefärbt wird.
Versuch 2: Brennendes Natrium-Schiffchen
Wir wiederholen den obigen Versuch, geben aber das Natriumstück auf ein Filterpapier, welches wir quasi in Form eines kleinen Schiffchens auf die Wasseroberfläche legen. Bei diesem Versuch kommt es kurze Zeit später zu einer spontanen Entzündung. Wieso?
Erklärung:
Das Natriumteilchen kann sich jetzt nicht weiterbewegen, und durch den auftretenden Wärmestau kommt es zu einer Zündung des Wasserstoffs.
Literaturhinweis
WIDETSCHEK O.: DER GROSSE Gefahrgut-Helfer – Gefahren, richtiges Verhalten und Einsatzmaßnahmen bei Schadstoff-Unfällen; Leopold Stocker Verlag, Graz-Stuttgart, 2012. In diesem Lehrbuch werden die meisten der hier wiedergegebenen Experimente ausführlich beschrieben. Bestellungen über www.brandschutzforum.at – Shop.



Autor:
ELFR Dr. Otto Widetschek

Die Redaktion ersucht, den Warnhinweis zu beachten. Alle dargestellten Versuche bergen bei unsachgemäßer Ausführung Gefahren in sich. Bei Unfällen wird seitens der Redaktion keine Haftung übernommen.