DIE FIREBUSTERS
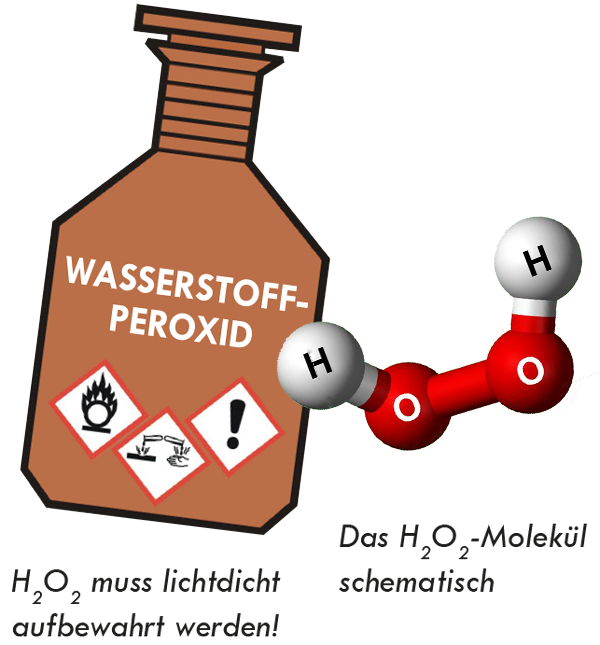
Wasserstoffperoxid
Einer der wichtigsten brandfördernden Stoffe ist das Wasserstoffperoxid, früher Wasserstoffsuperoxid genannt. Es ist eine glasklare Flüssigkeit und wird in der Praxis häufig mit Konzentrationen über zehn Prozent verwendet. In dieser Form wirkt es als starkes Oxidationsmittel und wird unter anderem bei der Verpackung von Lebensmitteln (Keimfreimachung von Verpackungsmaterialien), bei Pharmaprodukten (Antiseptikum) und im angewandten Umweltschutz zur Entgiftung von cyanidhaltigen Abwässern, aber auch als Desinfektionsmittel für Trink- und Schwimmbadwasser eingesetzt.
In
hochprozentiger Form wurde Wasserstoffperoxid im Zweiten Weltkrieg sogar als Raketentreibstoff verwendet und diente auch zur Herstellung von U-Boot-Antriebsmitteln. Schon aus alten Zeiten kennen wir die bekannteste Anwendung von Wasserstoffperoxid in der Kosmetik bzw. beim Friseur als Haarbleichmittel. Der Begriff der
„Wasserstoffblondine“ hat sich bis heute erhalten. Auch wird es in 3%iger Form als Gurgelmittel eingesetzt.
In hochprozentiger Form wurde Wasserstoffperoxid im Zweiten Weltkrieg sogar als Raketentreibstoff verwendet und diente auch zur Herstellung von U-Boot-Antriebsmitteln. Schon aus alten Zeiten kennen wir die bekannteste Anwendung von Wasserstoffperoxid in der Kosmetik bzw. beim Friseur als Haarbleichmittel. Der Begriff der „Wasserstoffblondine“ hat sich bis heute erhalten. Auch wird es in 3%iger Form als Gurgelmittel eingesetzt.
Chemischer Aufbau
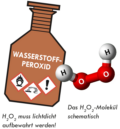
Chemisch gesehen besteht ein Molekül Wasserstoffperoxid aus zwei Wasserstoff und zwei Sauerstoffatomen (H2O2). Durch Wärmezufuhr oder durch Katalysatoren (z. B. Verunreinigungen, in welchen sich immer Reste von Schwermetallen befinden) kann sich Wasserstoffperoxid gemäß der Reaktion in Wasser (H2O) und Aktivsauerstoff (O*) zerlegen. Dieser atomare Sauerstoff (durch ein Sternchen gekennzeichnet) wirkt nun stark oxidierend. Wasserstoffperoxid ist also nicht brennbar, erzeugt aber bei seiner Zersetzung Sauerstoff, welcher im Augenblick des Entstehens (statu nascendi) sehr reaktionsfreudig ist. Der große Vorteil von H2O2 ist aber, dass nach der Zersetzung ein chemisch harmloses Wassermolekül übrigbleibt.
Physiologische Wirkungen
Wasserstoffperoxid wirkt stark ätzend, besonders auch als Dampf. Bei Hautkontakt mit der flüssigen Phase sollte man die Stelle mit Wasser sofort gut spülen (Verdünnung) oder zumindest sofort von der Haut entfernen. Dringt es in die Haut ein, so zersetzt es sich dort rasch, und die entstehenden Sauerstoffbläschen lassen die Haut weiß erscheinen. Allgemein wirkt Wasserstoffperoxid zytotoxisch (Schädigung der Gewebezellen) und durch seine starke Toxizität gegenüber vielen Kleinstlebewesen desinfizierend.
Literaturhinweis
WIDETSCHEK O.: Der große Gefahrgut-Helfer – Gefahren, richtiges Verhalten und Einsatzmaßnahmen bei Schadstoff-Unfällen; Leopold Stocker Verlag, Graz-Stuttgart, 2012. In diesem Lehrbuch werden die meisten der hier wiedergegebenen Experimente ausführlich beschrieben. Bestellungen über www.brandschutzforum.at – Shop.
EXPERIMENT: GEIST AUS DER FLASCHE
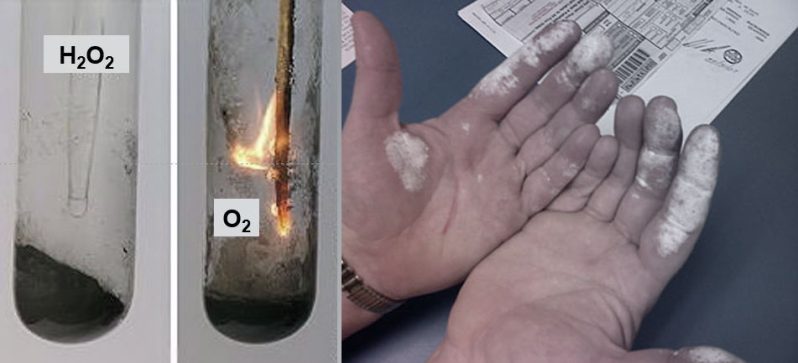
Das vor allem als Bleichund Oxidationsmittel in der täglichen Praxis verwendete Wasserstoffperoxid (H2O2) ist ein starkes Oxidationsmittel. Es reagiert daher kräftig mit Metallen und kann sich bei Verunreinigungen und Zugabe bestimmter Substanzen unkontrolliert zersetzen.
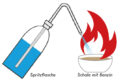
Versuch 1: Zersetzung von H2O2
Ein einfacher Versuch, bei dem anschaulich gezeigt wird, dass aus dem Oxidationsmittel Wasserstoffperoxid Sauerstoff abgespalten werden kann.
Materilaien:
- Erlenmeyerkolben (500 ml)
- Pipette
- Holzspan
- Gasbrenner
- Schutzbrille und Schutzhandschuhe
- 10%iges Wasserstoffperoxid
- Braunstein
Der Versuch:
In den Erlenmeyerkolben werden etwa 0,6 g Braunstein gegeben. Dazu tropft man langsam mit der Pipette 1 bis 2 ml des 10%igen Wasserstoffperoxids. Der bei dieser Reaktion entstehende Sauerstoff wird mit einem glimmenden Span nachgewiesen.
Erklärung:
Der Braunstein zerlegt durch katalytische Wirkung das Wasserstoffperoxid (H2O2) in Wasser (H2O) und atomaren Sauerstoff (O*), welcher sich in molekularen Sauerstoff (O2) umwandelt.
Sicherheitshinweise und Entsorgung:
Unbedingt Schutzbrille tragen! Die Reaktion kann sehr heftig verlaufen. Der Braunstein kann nach dem Trocknen wiederverwendet werden.
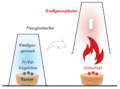
Versuch 2: Der Geist aus der Flasche
Wer möchte nicht den geheimnisvollen Geist aus dem Märchen Aladdin und die Wunder -lampe beschwören. Mit diesem Experiment können Sie einen spektakulären Effekt erzielen.
Materilaien:
- Standkolben mit großer Öffnung
- Spatel,
- Schutzhandschuhe,
- Schutzbrille
- 30%iges Wasserstoffperoxid
- Kaliumpermanganat
Der Versuch:
In den Standkolben werden 100 ml 30-prozentiges Wasserstoffperoxid gefüllt. Gibt man etwa 0,2 g festes KMnO4 dazu, erfolgt eine spontane heftige Reaktion. Im Kolben entwickelt sich eine große Menge Wasserdampf und Sauerstoff. Wie ein Geist aus der Flasche entweicht dieses Gemisch mit lautem Zischen.
Erklärung:
Das Permanganat wird in diesem Versuch von Wasserstoffperoxid zu katalytisch wirken den Mangan(IV)oxid (MnO2 = Braunstein) reduziert.
Entsorgung:
Das Reaktionsgemisch so lange stehen lassen, bis die Gasentwicklung beendet ist. Die wässrige Lösung kann gefahrlos in das Abwasser gegeben werden.
Sicherheitshinweise:
Die Reaktion verläuft sehr heftig und der Glaskolben wird sehr heiß. Keinen Kolben mit kleiner Öffnung verwenden. Immer Schutzbrille tragen! 30%ige H2O2-Lösung wirkt stark ätzend, jeder Kontakt mit der Haut und den Augen muss vermieden werden. Im Falle eines Kontaktes mindestens zehn Minuten lang mit Wasser spülen.

Autor:
ELFR Dr. Otto Widetschek

Die Redaktion ersucht, den Warnhinweis zu beachten. Alle dargestellten Versuche bergen bei unsachgemäßer Ausführung Gefahren in sich. Bei Unfällen wird seitens der Redaktion keine Haftung übernommen.